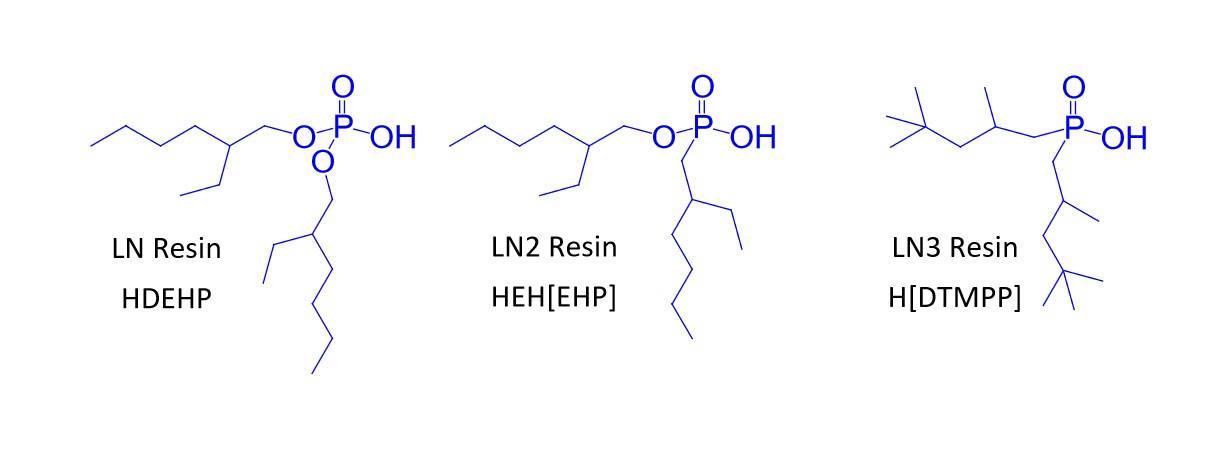
Lnレジンシリーズ(Ln, Ln2, Ln3レジン)

Lnレジンシリーズ(Ln, Ln2, Ln3)は、不活性支持体に酸性アルキルリン抽出剤を含侵したレジンで、86Y (1)、89Zr (2)、161Tb、177Lu (3)のような核医学アイソトープの精製や、様々な分析アプリケーション(4~7)に使用されてきました。
Lnレジンシリーズは、特に隣接三価希土類とアクチノイド金属イオンの分離に使用できます。このアプリケーションに利用可能なEichrom社製品(Figure 2およびTable 1)の中では、最も高い分離係数を示す例もあります。LnとLn2はDGAレジンと組み合わせて、177Luおよび161Tbを含む核医学アプリケーションの高比放射能希土類核種の製造に利用されて来ています(3)。
LnとLn2における隣接希土類の分離係数は類似しています(Table 1)。しかし、一定の水溶液酸性度における金属イオンの保持は、Ln>Ln2>>Ln3の順に減少します。これは、P-OR結合が順次P-R結合に順次置き換わり、抽出剤の酸性度が低下するためです(Figure 2~3)(8,9)。Ln2とLn3の違いは、2,4,4-トリメチル-ペンチル基グループ(Ln3)と、2 -エチル-1-ヘキシル基グループ(LnおよびLn2)の増大した立体障害の付加作用によって大きくなります。
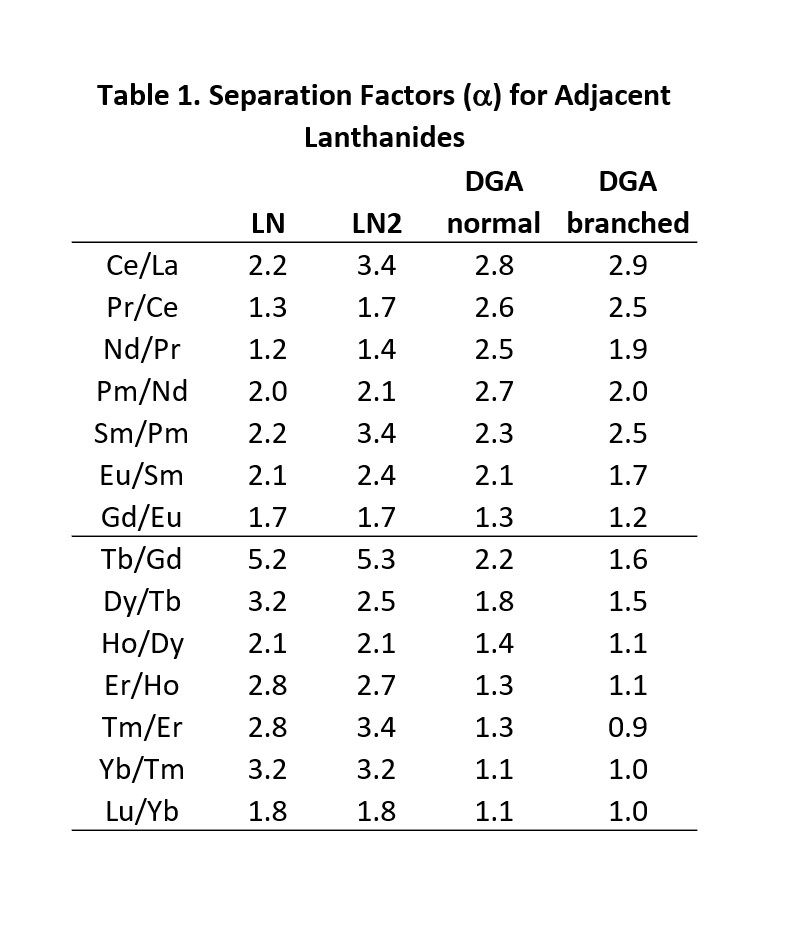
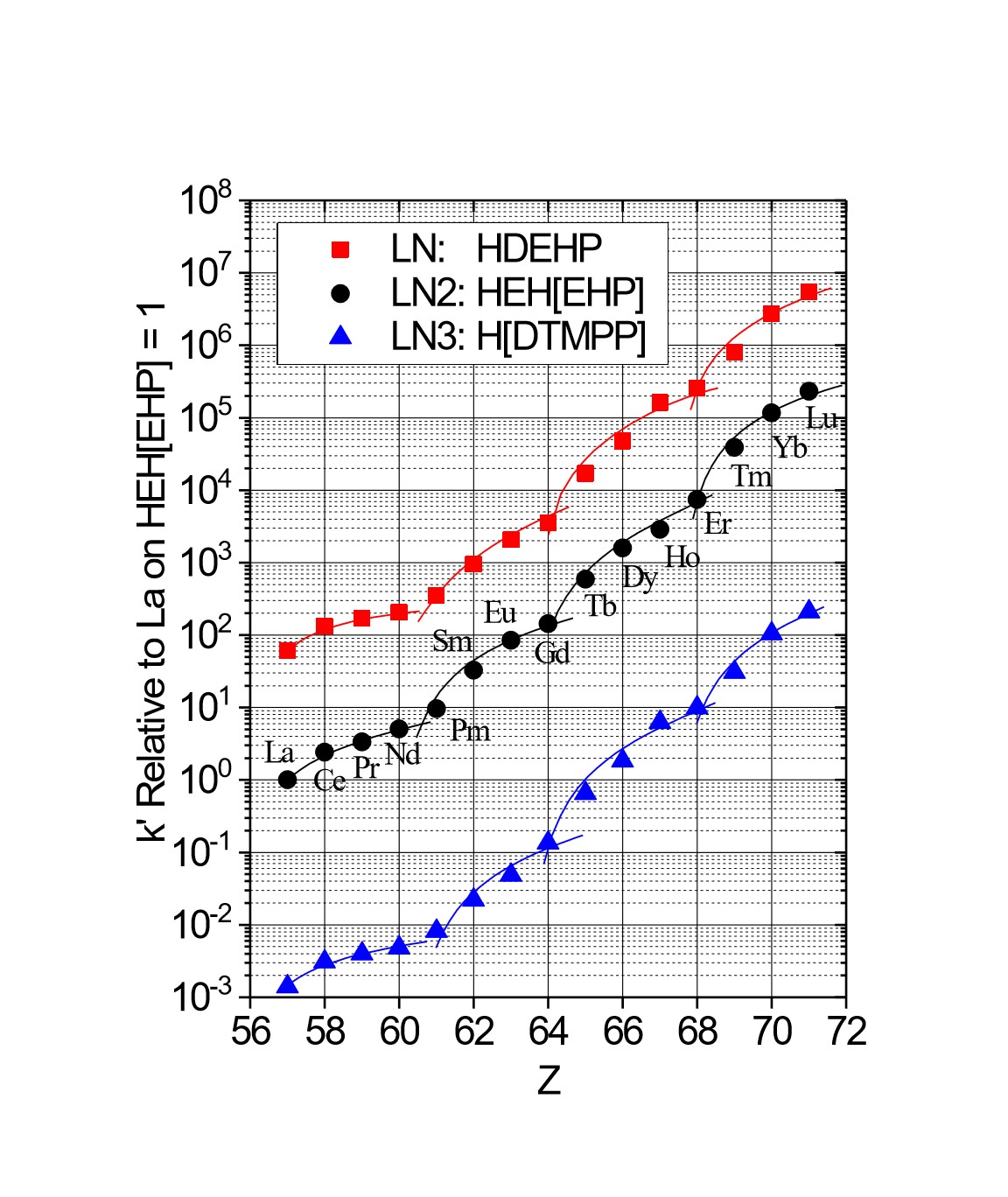
Figure 2a:Ln, Ln2, Ln3レジンの三価希土類金属イオンの相対k’値(硝酸)
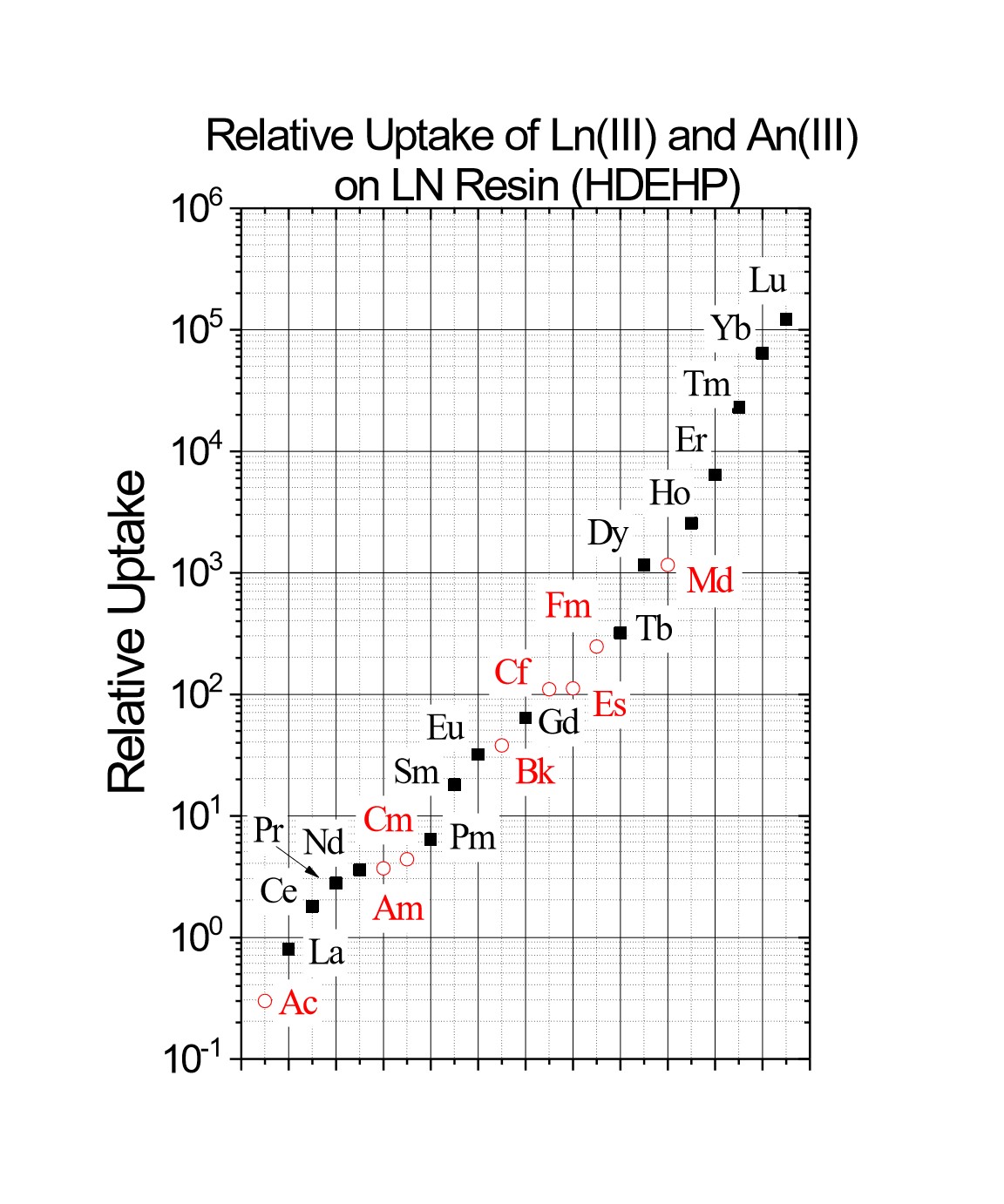
Figure 2b:Lnレジンの三価希土類および三価アクチノイド金属イオンの相対k’値(硝酸)
下記Figure 3は、硝酸条件でLn、Ln2、Ln3レジンの希土類のk’値をプロットしたものです。最も高いk’値であるLnレジンが、軽希土類(La-Tb)の分離に有効です。
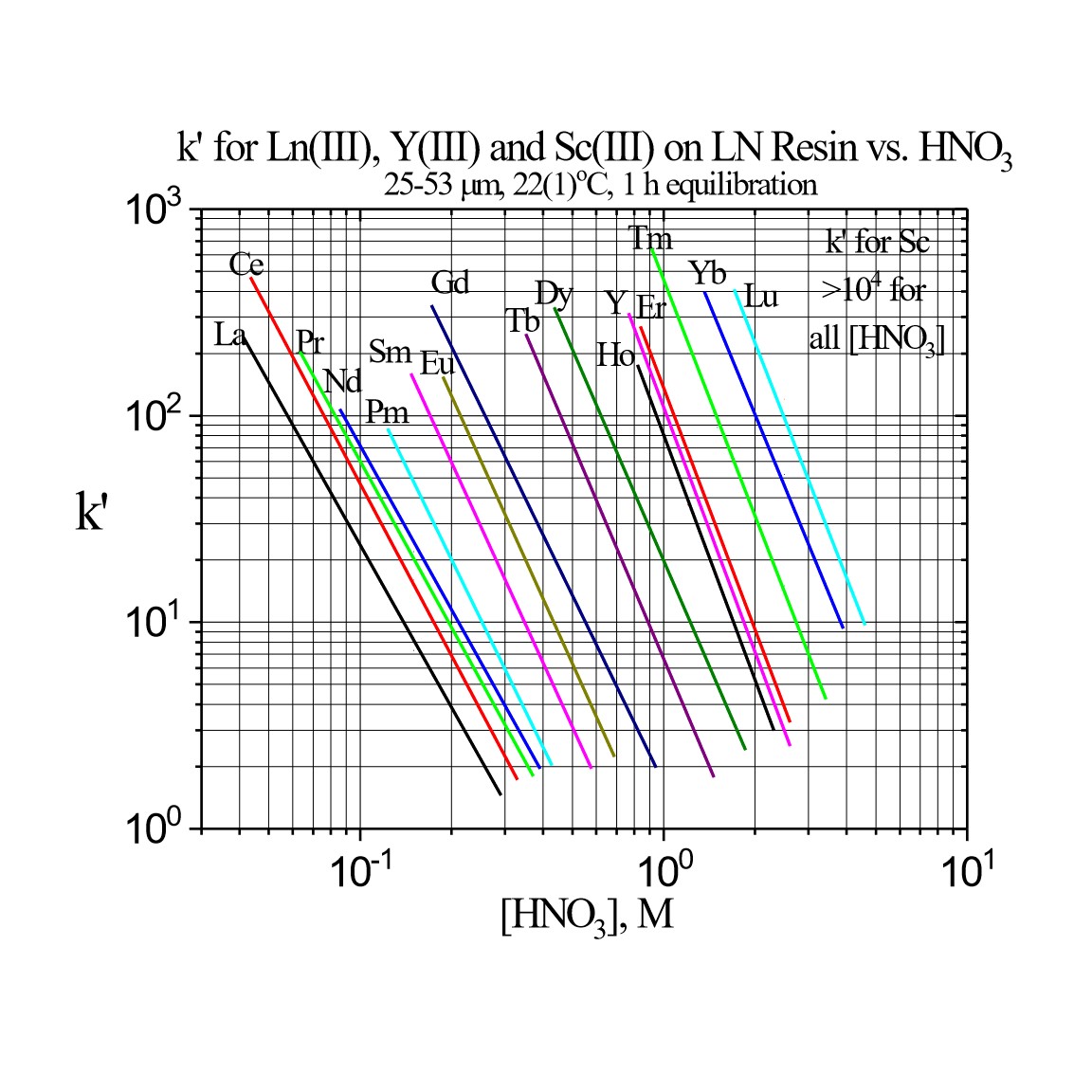
Figure 3a:Lnレジンの三価希土類金属イオンのk’値(硝酸)
これらの金属イオンをLn2レジンから回収する際に、Lnレジンに使用するより薄い酸を使用できるため、Ln2レジンは重希土類(Dy-Lu、Y、Sc)の分離によく使用されます。
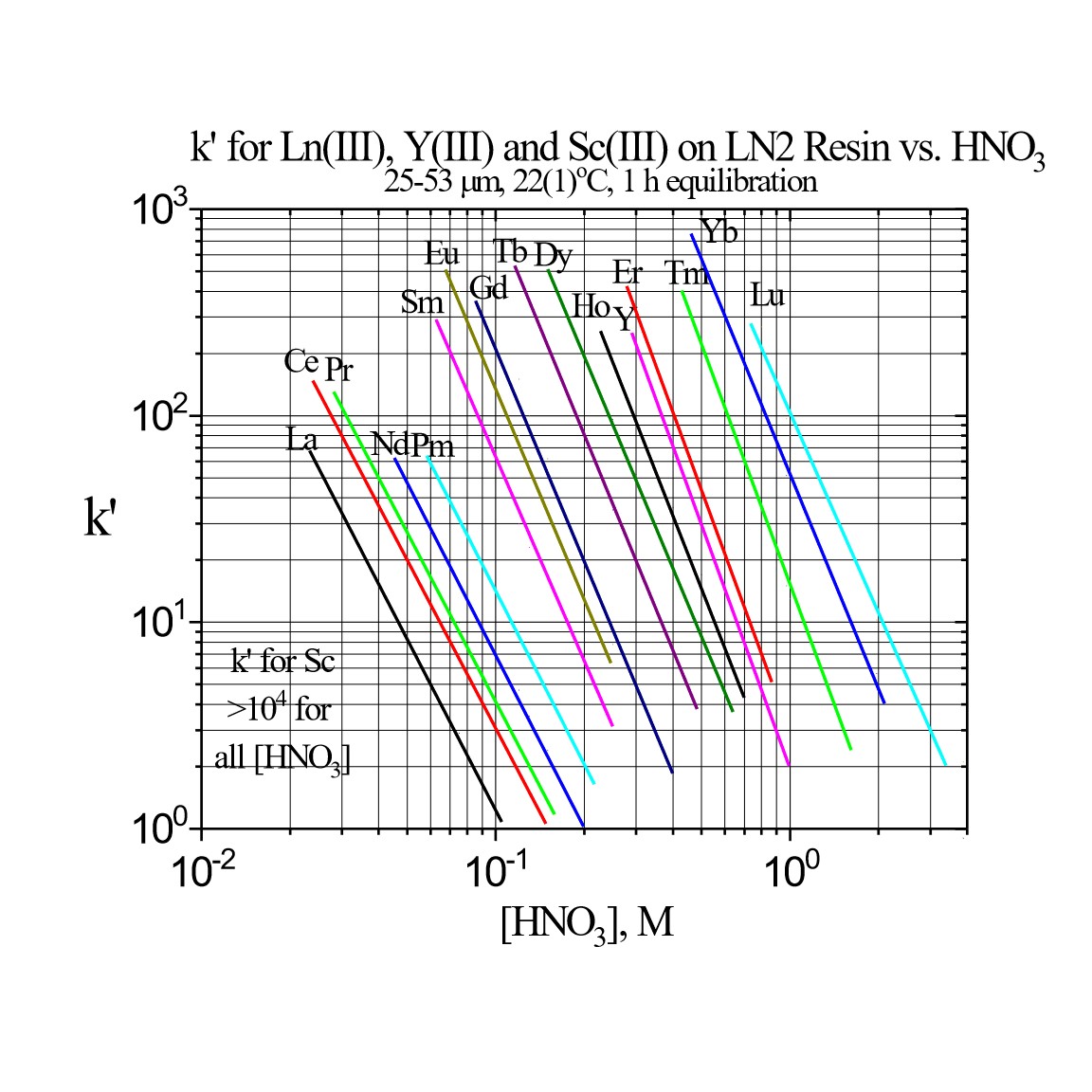
Figure 3b:Ln2レジンの三価希土類金属イオンのk’値(硝酸)
Ln3レジンによる三価希土類の保持には非常に希薄な酸を使用しますが、これは多くの分離メソッドにおいて現実的ではありません。そのため、Ln3レジンは主としてZr(IV)やU(IV)のような価数の大きい金属イオンの分離に使用され、ほとんどの三価、二価、一価の金属イオンを除去します。
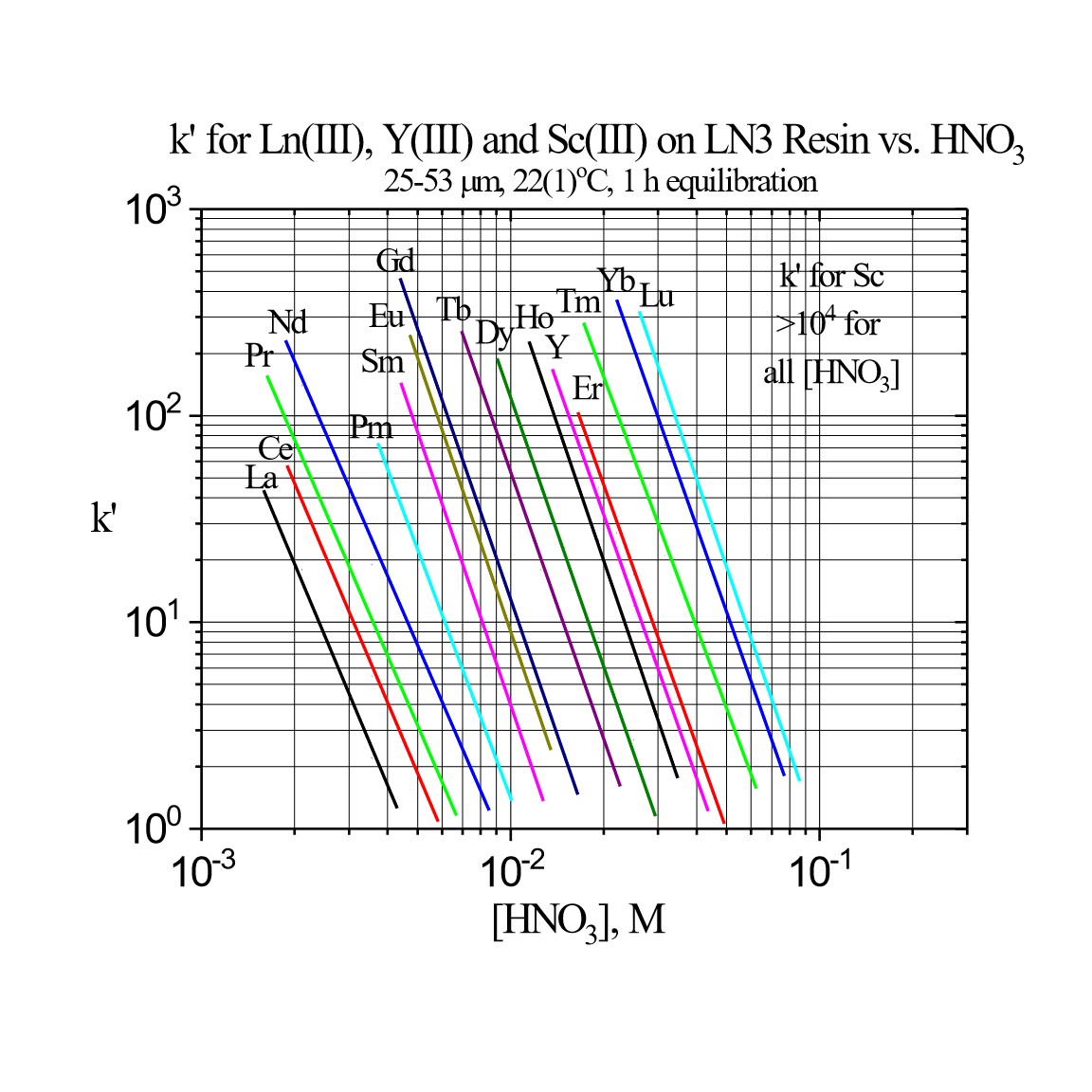
Figure 3c:Ln3レジンの三価希土類金属イオンのk’値(硝酸)
Lnレジンシリーズに使用されているアルキルリン抽出剤の溶解度は、移動相のpHが高くなるにつれて上昇します。そのため、Lnレジンシリーズへの充填や溶出に使用する移動相はpH3未満を維持することを推奨します。Lnレジンシリーズで高いpHの移動相を使用すると、抽出剤が大幅に失われる可能性があります。
P-OH基の酸性度が下がると、Figure 4の平衡は(a)から(b)、そして(b)から(c)へと酸性水溶液条件において完全に移行します。低酸性の水相からの金属イオンの抽出は、Figure 4(a)に概略を示すように、第一に陽イオン交換メカニズムによって実行されます。有機リン抽出剤の水素結合凝集であったものが、Figure 4(d)では抽出時に金属イオンの電荷と同じ陽子数の変換が行われます。この抽出メカニズムが作用しているとき、Dw値(またはk’やD)対 平衡水性酸活性の両対数グラフは、抽出種(および交換された陽子の数)の金属イオンの電荷数と同様の負の傾きを示します。
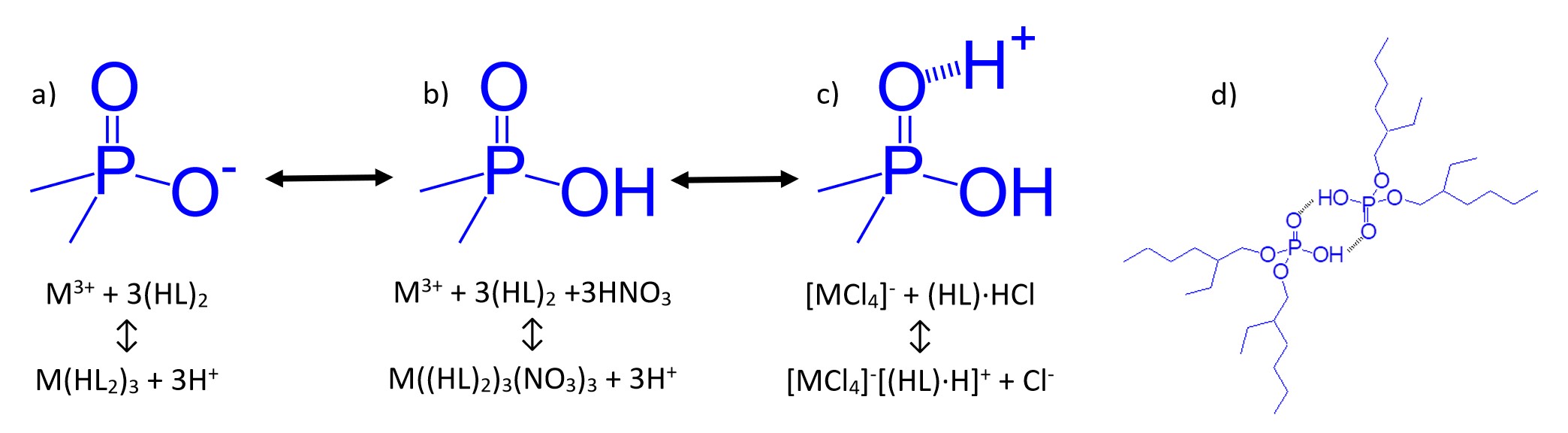
Figure 4:Lnシリーズ抽出剤の抽出平衡
水相における酸濃度が高くなると、平衡は4(a)から4(b)へと移行し、P-OH基が完全にプロトン化されます。この条件下では、ほとんどの三価希土類やアクチノイド、そしてより低い価数の金属イオンはほとんど抽出されません。しかし、硫酸イオンや塩化物イオンの共抽出によって金属イオンの電荷が中和される(溶媒和)抽出メカニズムによる抽出のため、四価および六価アクチノイドの抽出率は高いままです。
酸濃度が非常に高いとき、有機リン抽出剤のP=O基は、P=O-H+NO3–またはP=O-H+Cl–を形成する大量の酸を抽出します。これらの酸付加物は、弱塩基性陰イオン交換体として機能し、陰イオン金属錯体を抽出して、NO3–またはCl–を交換します(Figure 4(c))。
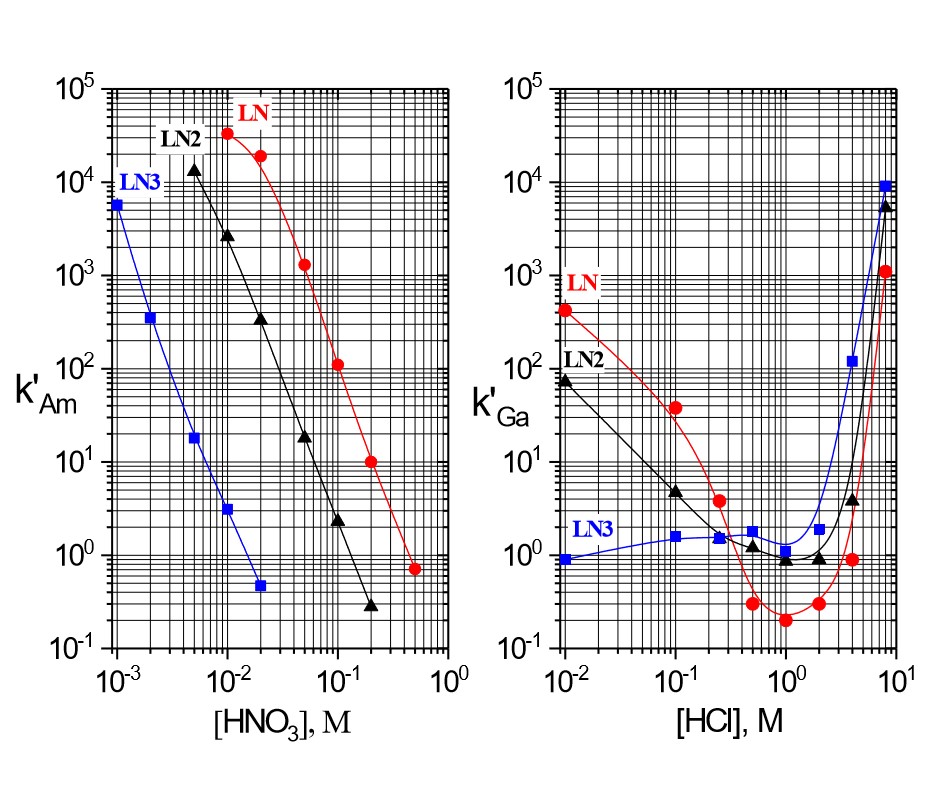
Figure 5:LnレジンシリーズのAm(Ⅲ)のk’値(硝酸) およびGa(Ⅲ)のk’値(塩酸)
Figure 5は3種類の抽出メカニズムの例です。硝酸条件では、LnレジンシリーズによるAm(Ⅲ)の抽出率は低酸濃度で最も高くなり、水相内の硝酸濃度が高まるにつれて、-3の両対数グラフの傾きとともに減少します。一定の酸濃度におけるAm(Ⅲ)抽出の強さは、P-OH基の酸性度が減少するLn>Ln2>>Ln3の順に減少します。塩酸におけるGa(Ⅲ)の抽出の場合、Gaのk’値対塩酸濃度の両対数グラフは低酸濃度におけるAm(Ⅲ)と同様の挙動を示しています。P-OH基はより高濃度の塩酸でプロトン化されると、Ga(Ⅲ)抽出率が非常に低くなります。これはGaCl3がプロトン化した中性抽出剤によってほとんど抽出されないためです。最も高濃度の条件では、Ga抽出率は上昇します。これはP=O基がプロトン化され、[GaCl4]–がFigure 4(c)で示されているような弱塩基性陰イオン交換メカニズムによって抽出されるためです。
DGAレジンは希土類元素の分離において、LnやLn2レジンとよく組み合わせて使用されます。LnシリーズとDGAレジンはお互いに補完し合う関係です。Lnレジンは一般的に希酸で通液し、それより高い濃度の酸で溶離しますが、DGAレジンは高濃度の酸で通液し、希塩酸で溶離します。そのため、カラム間で溶出液が蒸発することもなく、LnシリーズとDGAレジンは多数を交互に使用することが可能です。
Figure 6と7は、LnおよびLn2レジンの希土類元素に対する一般的な溶出曲線について示しています。DGAレジンの場合の溶出曲線は、DGAレジンのページでも紹介します。
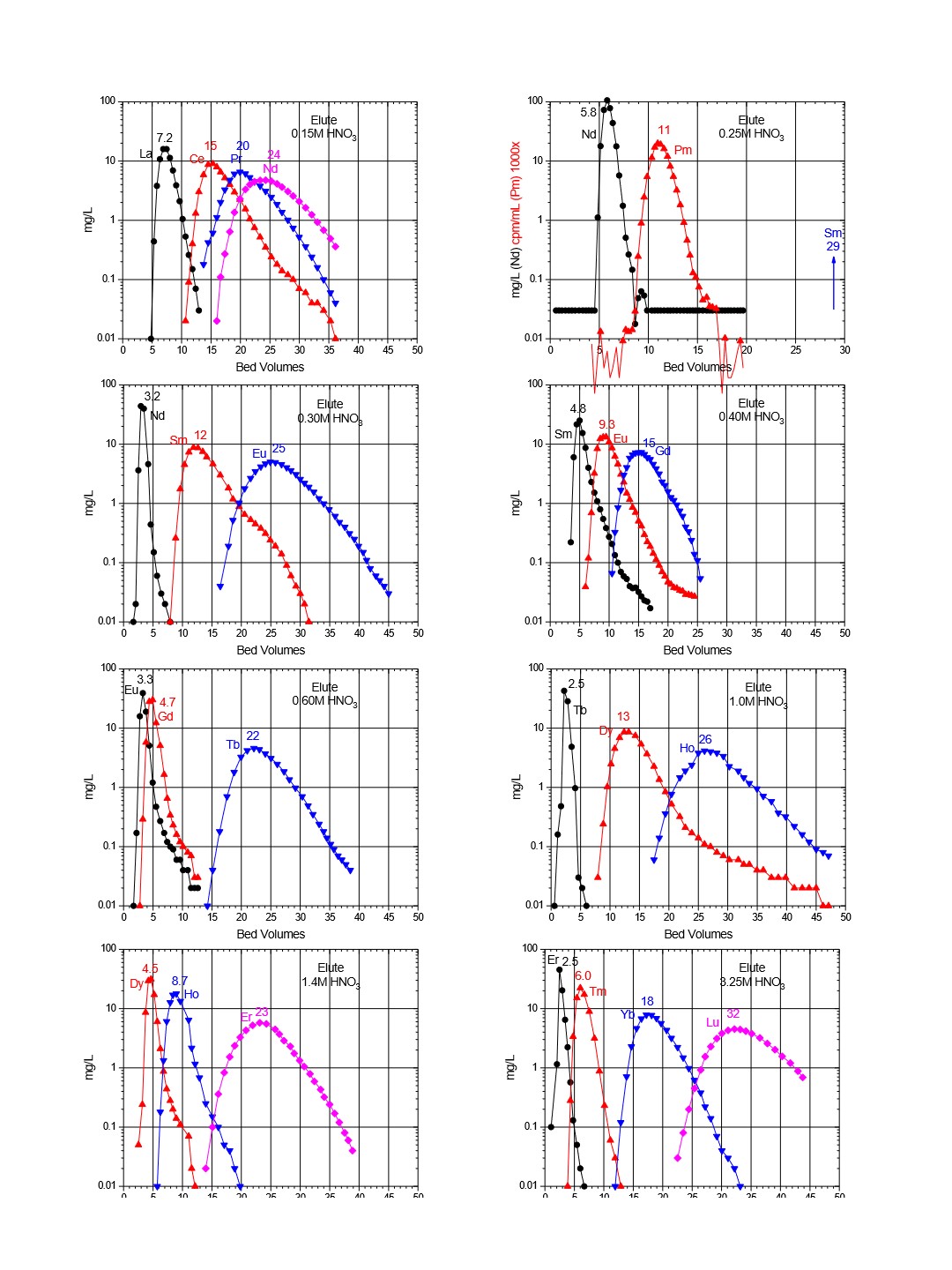
Figure 6:Lnレジンによる三価希土類金属イオンの溶出(硝酸、10mLカラム、25~50µm、21(1)C)
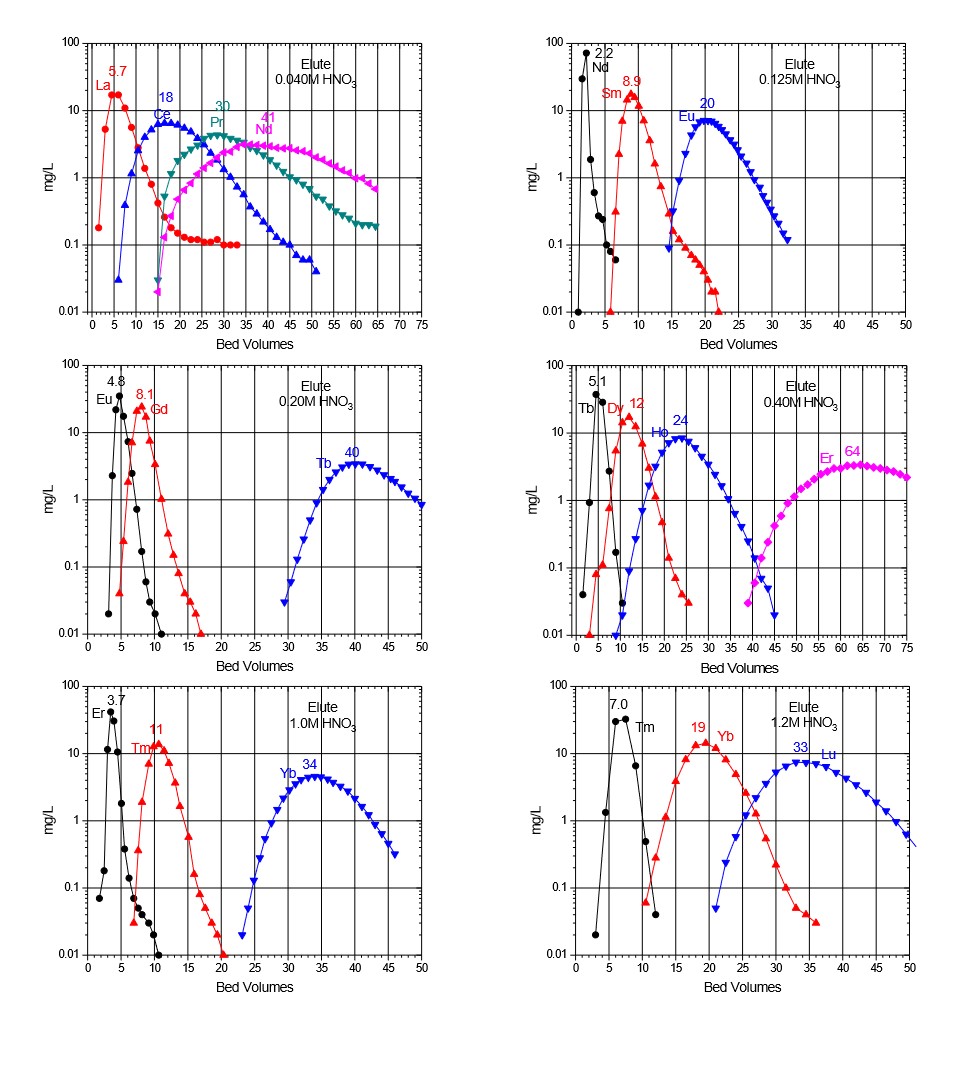
Figure 7:Ln2レジンによる三価希土類金属イオンの溶出(硝酸、10mLカラム、25~50µm、21(1)C)
Horwitz氏らの初期の研究では(10)、Lnレジンが硝酸条件で回収した様々な金属イオンに対する分配係数(Kd)について示しています。Figure 8はこれを再現したもので、今日における数多くの放射化学の分離の原点として使用されています。Figure 9および10(8)は、Ln、Ln2、Ln3の金属イオンの保持に関する追加データです。Lnレジンでは、Kdは4.33で割ることによってk’(フリーカラムボリュームからピーク最大値までの近似値)に変換することが可能です。
Lnレジンは、ラジウム、ネオジム、プロメチウムの分析に応用されてきました。Figure 8~10が示すように、より多くの分析アプリケーションに使用できます。
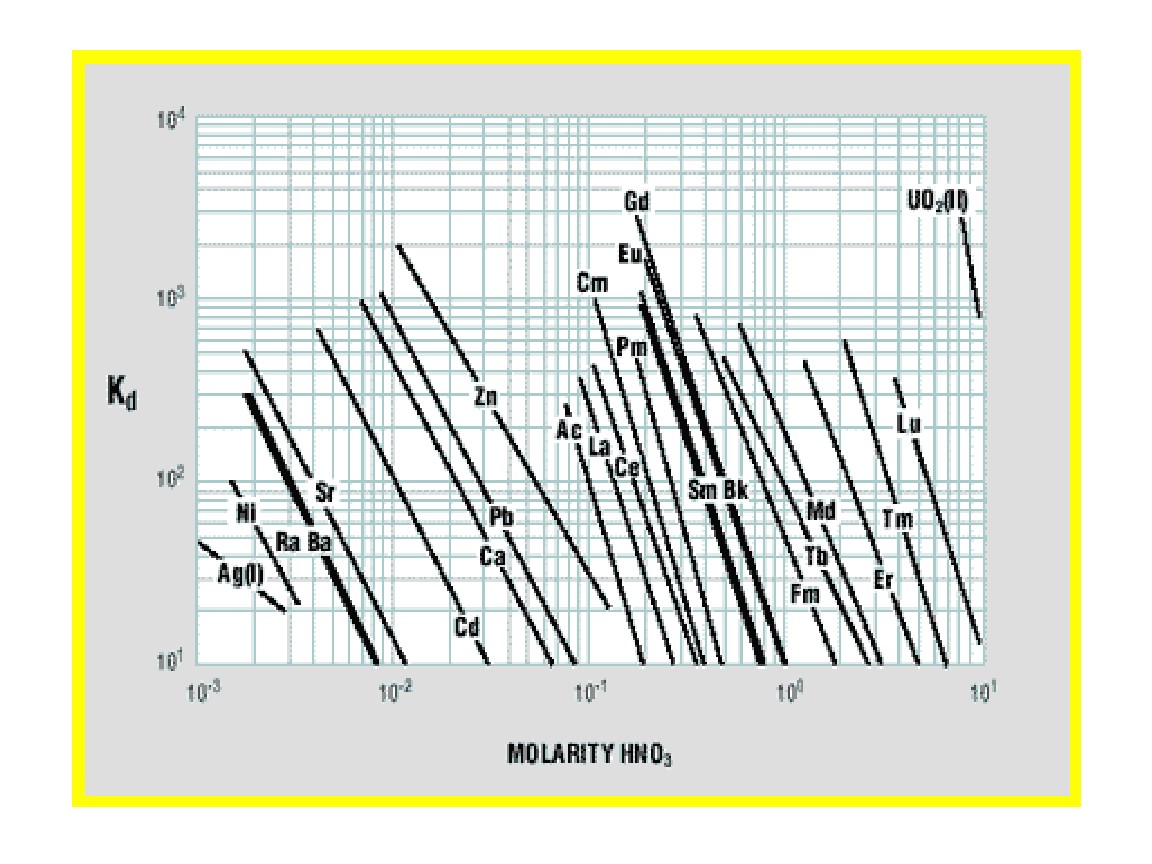
Figure 8:Lnレジンに選択された金属イオンの分配係数kd(硝酸)
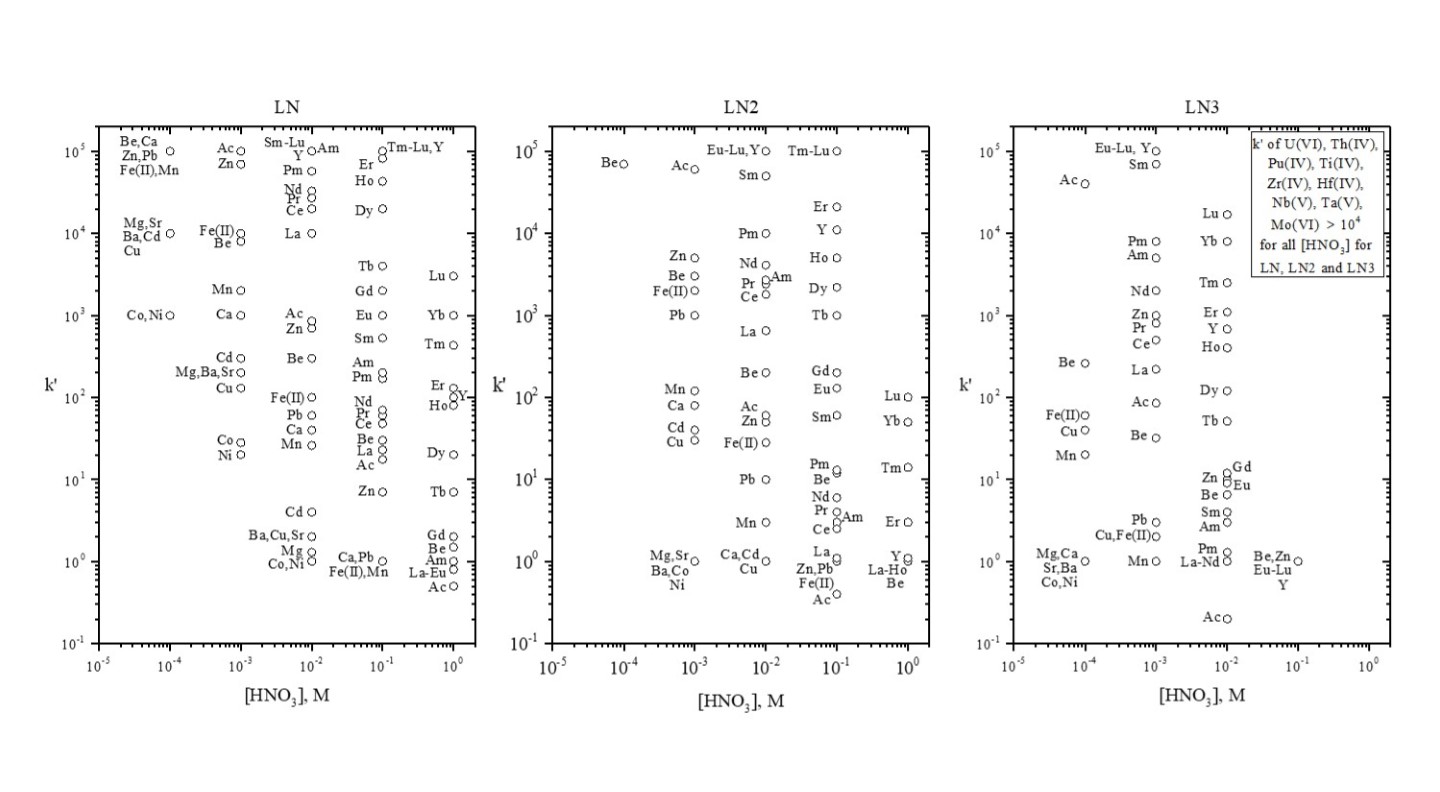
Figure 9:Ln、Ln2、Ln3レジンに選択された金属イオンのk'値(硝酸)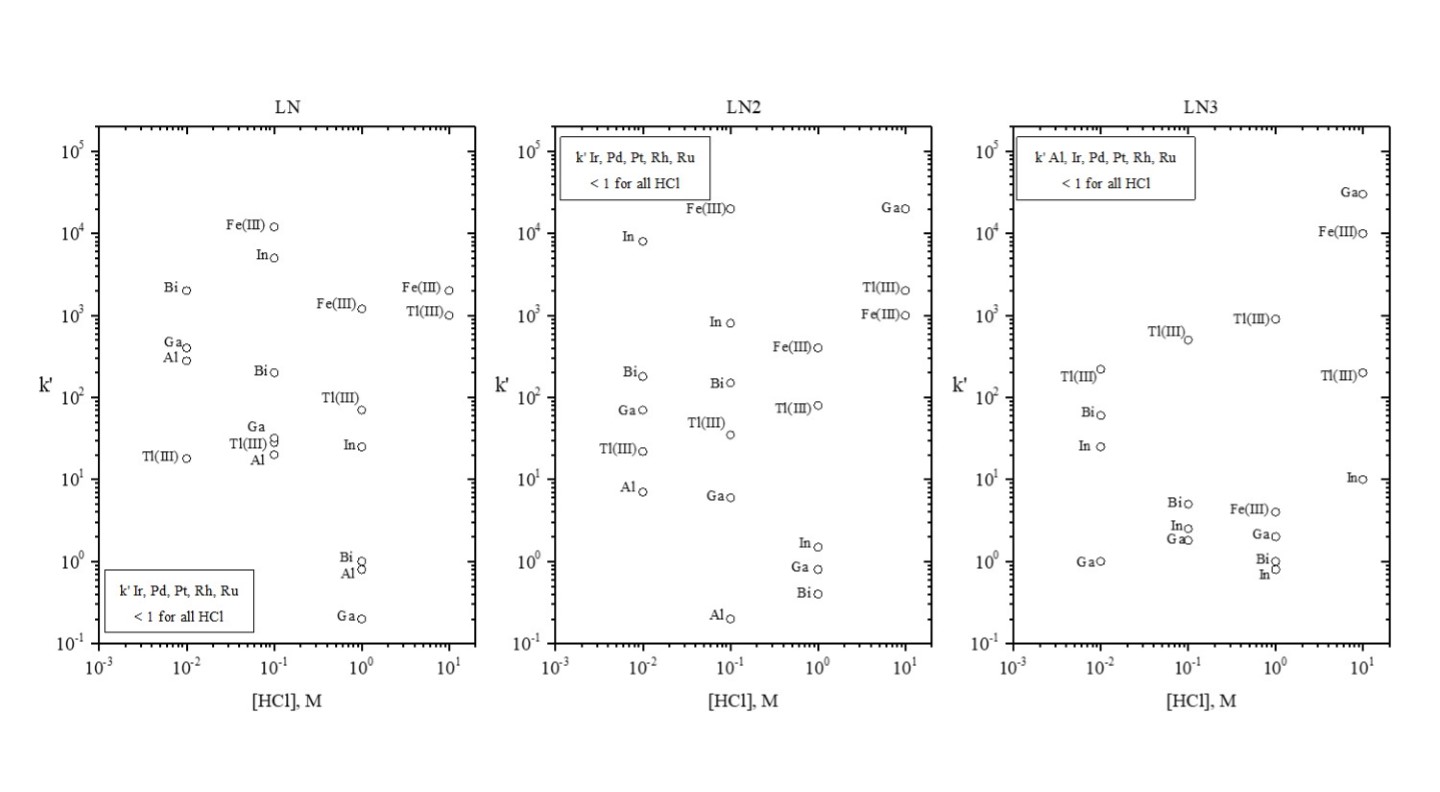
Figure 10:Ln、Ln2、Ln3に選択された金属イオンのk’値(塩酸)
Bill Burnett氏ら(4)は、Lnレジンを使用して直接ベータ粒子を放出する228Raの娘核種である228Acを選択的に抽出する228Raの分析手順を開発しました。Lnレジンは、EPA分析法Ra-05-1(EPA手順マニュアル520/5-84-006)で使用されているものと同じHDEHP抽出剤を採用しており、混合有機廃棄物を出しません。
Figure 11は、Bill Burnett氏の分析法の概要を説明しています。Raを濃縮する硫酸バリウム沈殿と炭酸バリウムの分子交換反応の後、サンプルを10mLの0.095M 硝酸で溶解し、228Acの成長に30時間置いてからLnレジン充填済みカラム(0.65g)に充填しました。カラムを15mLの0.095M硝酸で洗浄してアルカリ土類、鉛、その他の干渉物を除去し、充填および洗浄フラクションを回収して、ラドン放射による226Raを分析しました。
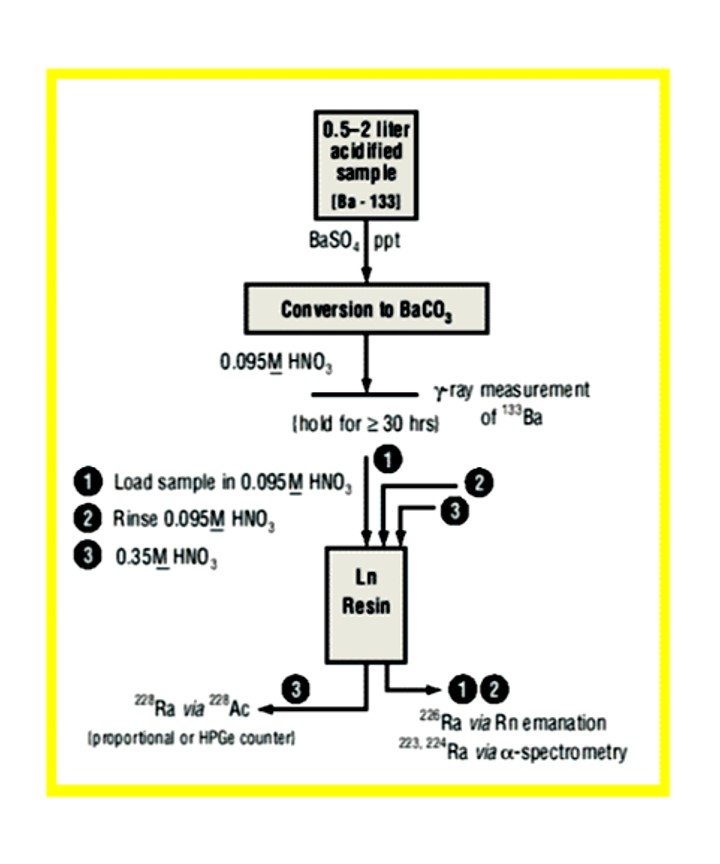
Figure 11:水サンプル中の228Ra分析の流れ
最終的に、10mLの0.35M硝酸を使用して、Lnレジンから定量的にアクチニウムを溶出し、228Ac標準線源をガス流量比例計数用に用意しました。ルーチン作業では、最小検出活性(MDA)である<1.0 pCi/L(0.037 Bq/L)が、2Lサンプルの30分測定において、80%バリウムの回収をもって達成されました。この分析法はUS-EPA研究室間の多数の228Raサンプル比較において、サンプルの分析に使用されました。結果はすべて、95%(2シグマ) 信頼区間において期待値と一致しました。Eichrom社でこの分析法をさらに発展させたEichrom分析法RAW03では、硫酸バリウム沈殿と炭酸バリウムの分子交換反応のステップを陽イオン交換による濃縮と置き換えています。アルファ線スペクトロメトリ―は、半減期の短い224Raと同様に、226Raの分析に使用されます。追加データは、2002年5月のEichrom North American Users’ Meetingにて発表されました。
Lnレジンは147Pm(5,6)の分析によく使用されます。原子力施設の環境、廃棄物サンプルでは、正確に測定するために他の核分裂生成物やアクチノイドからプロメチウムを分離する必要があります。147Pm水の測定法はCable氏らが概説しており(6)、リン酸カルシウム沈殿または蒸発によって0.5~2Lの水サンプルを濃縮しています。残渣を0.2M硝酸とアスコルビン酸で溶解すると、Fe(Ⅲ)はFe(Ⅱ)に還元されます。0.2M硝酸に入れたサンプルを標準のLnレジンカラムに充填し、0.2M硝酸による洗浄によって、アメリシウム、ストロンチウム、バリウム、ラジウム、セシウム、Fe(Ⅱ)や多数の他の干渉物を除去します。プロメチウムはビスマス、イットリウム、潜在的トレーサーのサマリウムやガドリニウムと共に保持されます。Fe(Ⅲ)はLnレジンに強力に保持されますが、55mgのFeを使用した実験では、LnレジンカラムからPmが破過しないことが分かっており、アスコルビン酸によるFe(Ⅲ)からFe(Ⅱ)への還元が効果的であることを実証しています。
プロメチウムは、サマリウムやガドリニウムトレーサーと一緒に、5mLの1M硝酸で溶出します。収率モニター用に148Gdを使用したとき、147Pmの補正回収率は88%を上回りました。60Co、134Cs/137Cs、89Sr/90Srから極めて高い汚染除去を達成しました。もう1つの潜在的干渉物は144Ceであり、ベータ線、ガンマ線を放出します。潜在的偽陽性の可能性を排除するため、ガンマ線スペクトロメトリ―を使用して確認する必要があります。
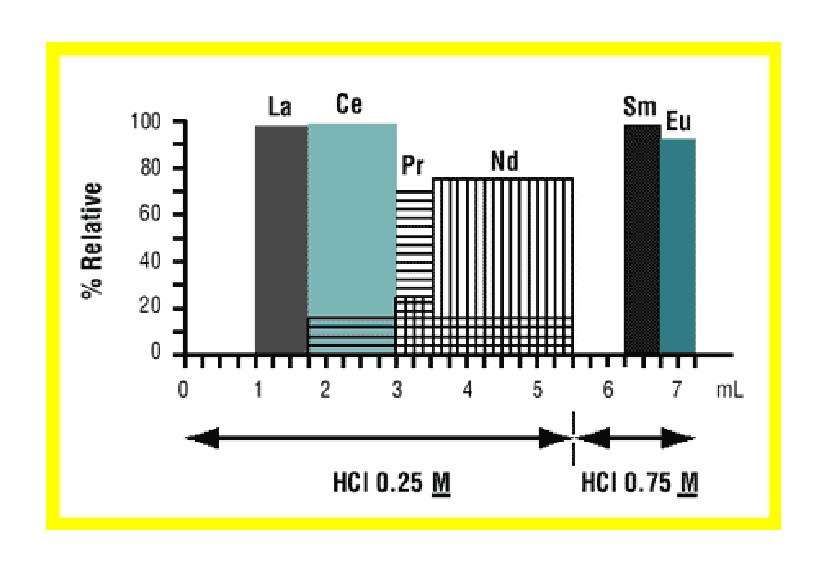
Figure 12:Lnレジンに選択された軽希土類元素からのSmおよびEuの分離
Christian Pin氏らは(7)、ケイ酸塩岩内のSm、Nd、Th、U の一連の分離の分析法を発表しました。この分析法は、TRUレジンをLnレジンと直列して使用します。玄武岩質サンプルのような鉄を多く含むサンプルの場合、50W×4の強酸性の陽イオン交換カラムを使用して前もってFeを除去します。サンプルを溶解し、陽イオン交換レジンを用いて可能な限り処理した後、このサンプルを1M硝酸の入ったTRUレジンのカラムに充填します。1M硝酸でTRUレジンを洗浄することで、多くの不純物を除去できます。その後、 軽希土類元素(LREE)は0.05M硝酸で溶離できます。TRUレジンカラムからこのLREEフラクションをLnレジンのカラムへ直接流し込んで、LREE を保持します。Figure 12は、Sグレード(50~100µm)のLnレジンを0.3g用いたカラムによるLa、Ce、Pr、Nd、Sm、Euの溶出挙動を示しています。0.25M塩酸を計5.5mL使用してLa、Ce、Pr、Ndを溶出しますが、Sm は、ID-TIMS分析法で検出されない程度です。その後、SmとEuは、0.75M塩酸による溶出によって回収されます。ケイ酸塩岩の15種類の国際的な標準物質を用いて比較を行ったところ、十分に一致しました。
LnレジンのNdの最大抽出量は、1mLレジンあたり約22mgと算出されています。しかし、ほとんどの分析過程において、この量の10~20%を超えたり、充填済Lnカラム/カートリッジで、レジン1mLあたり2~4mg、2mLあたり4~8mgを超えることは好ましくありません。
参考文献
1) Eichrom Application Note AN-1623, “Separation of 86Y from Strontium Target”
2) Eichrom Application Note AN-1622, “Separation of 89Zr from Yttrium Target with LN3 Resin”
3) E. P. Horwitz, D. R. McAlister, A. H. Bond, R. E. Barrans, J. M. Williamson, “A Process for the Separation of 177Lu from Neutron Irradiated 176Yb Targets,” Applied Radiation and Isotopes, 63, 23-36 (2005).
4) Burnett, W., Cable, P., Moser, R. Determination of Radium-228 in Natural Waters Using Extraction Chromatographic Resins, Radioactivity & Radiochemistry, Vol. 6, No. 3, pp. 36-44, (1995).
5) Pm Separation via Ln Resin-A Progress Report, 41st Annual Conference On Bioassay, Analytical & Environmental Radiochemistry (Eichrom Workshop). Boston, MA, (1995).
6) Burnett, W.; Cable, P.; Wong, R.; Corbett, D.R.; Schultz, M.; Stewart, B.; Westmoreland, J. Pm/Sm Separation via Ln Resin, Eichrom Atlanta Users’ Seminar, Atlanta, GA, (1996).
7) Pin, C., et al. Sequential Separation of Light Rare-Earth Elements, Thorium and Uranium by Miniaturized Extraction Chromatography: Application to Isotopic Analyses of Silicate Rocks, Analytica Chimica Acta,Vol. 339, pp. 79-89, (1996).
8) D. R. McAlister, E. P. Horwitz, “The Characterization and Novel Applications of Extraction Chromatographic Materials Containing Bis(2-ethyl-1-hexyl)phosphoric Acid, 2-ethyl-1-hexylphosphonic acid, mono 2-ethyl-1-hexyl ester and 2,4,4-trimethyl-1-pentylphosphinic acid,” Solv. Extr. Ion Exch., 25(6), 757-769 (2007).
9) E. P. Horwitz, D. R. McAlister, M. L. Dietz, “Extraction chromatography versus solvent extraction: How similar are they?” Sep. Sci. and Technol., 41(10), 2163-2182 (2006).
10) Horwitz, E.P., Bloomquist, C.A.A., Chemical separations for super-heavy element searches in irradiated uranium targets. J. Inorg. Nucl. Chem. 37, 425–434 (1975).
アプリケーションノート
取扱仕様
| Lnレジン | |||
| 粒 径 | 容 器 | 入 数 | 商品番号 |
|
100 ~ 150 µm |
ボトル |
25g | LN-B25-A |
| 50g | LN-B50-A | ||
| 100g | LN-B100-A | ||
| 200g | LN-B200-A | ||
| カラム(2mL) |
50個入 |
LN-C50-A | |
| 50 ~ 100 µm | ボトル | 25g | LN-B25-S |
| 50g | LN-B50-S | ||
| カートリッジ(2mL) | 50個入 | LN-R50-S | |
| 20 ~ 50 µm | ボトル | 10g | LN-B10-F |
| Ln2レジン | |||
| 50 ~ 100 µm | ボトル |
10 g |
L2-B10-S |
| カートリッジ(2mL) |
50個入 |
L2-R50-S | |
| 20 ~ 50 µm | ボトル | 10 g | L2-B10-F |
| Ln3レジン | |||
| 50 ~ 100 µm | カートリッジ(2mL) | 50個入 | L3-R50-S |